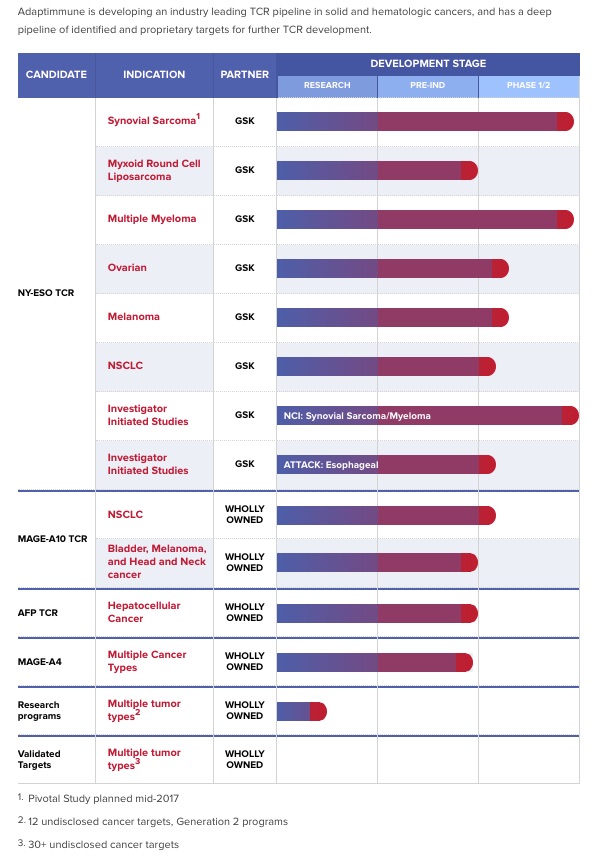
will ich hier mal mit dem Vergleich zur aktuellen Adaptimmune TCR Pipeline beantworten:
Man sieht dort sehr schön was mit den zufällig ebenfalls 4 dort bislang bekanntgewordenen TCR-Zielmolekülen NY-ESO, MAGE-A10, AFP und MAGE-A4 an Krebsindikationen angegangen wird. NY-ESO ist sicher ein Sonderfall, aber 2-3 mögliche Indikationen pro Zielmolekül sollten die Regel sein.
DL hat in einem Interview wohl von Dutzenden von Zielmolekülen in der Medigene TCR Bibliothek gesprochen. Adaptimmune gibt mehr als 30 unveröffentlichte Zielmoleküle gegen Krebs an und hat für weitere 63 gerade die Patentanträge gestellt. Ein gewaltiges Potential an Zielmolekülen und der grösste Vorteil von TCR gegenüber den klassischen monoklonalen Antikörper Bibliotheken wie die von Morphosys, BiSpezifika wie Blincyto von Amgen oder den aktuellen CAR-T Immuntherapie-Ansätzen!
Natürlich kann nicht jede Kombination den Markt einer Krebsindikation komplett für sich beanspruchen und die Tendenz geht auch hier zu Kombinationen, wenn nicht alle Zellen eines Tumors das entsprechende Zielmolekül aufweisen. In der Adaptimmune-Pipeline zum Beispiel die TCRs gegen die Zielmoleküle NY-ESO und MAGA-A10 beide für nicht-kleinzelligen Lungenkrebs (NSCLC). Dass heisst in der Zukunft könnte man viellleicht nicht mehr von einzelnen Krebsindikationen nach der Art der befallen Organe (Lungen-, Haut-, Eierstock-, Brustkrebs etc) ausgehen sondern nach den im Tumorgewebe vorhandenen Krebsantigenen wie z.B. NY-ESO/ MAGE-A1 Krebs.
Anders als bei monoklonalen Antikörpern wird ausserdem pro MHC-Patientengruppe ein eigener TCR benötigt, um körpereigene von körperfremden Zellen zu unterscheiden (die sogenannte MHC-Restriktion der TCR). Adaptimmune geht davon aus mit 3 TCRs pro Zielmolekül eine ca 70% MHC-Abdeckung der Bevölkerung zu erreichen.
Vielleicht nicht ganz einfach zu verstehen und daher mit dem Apfel vs. Apfelschalen Vergleich von Medigene sehr gut veranschaulicht. Medigene TCR-Bibliothek kann potentiell den ganzen Apfel untersuchen, während der grosse Rest der zielgerichteten Krebstherapien nur die Apfelschale sieht. Die MHC-Restirktion ist dabei als eine zusätzliche Sicherheitsbarriere anzusehen, die verhindert, dass die T-Zellen körpereigene Zellen ausser den Krebszellen angreifen.
Meine vereinfachte Sicht der Dinge ohne wissenschaftlichen Anspruch! |
Angehängte Grafik:
adap-pipeline-201610-web.jpg (verkleinert auf 85%)



 Thread abonnieren
Thread abonnieren


