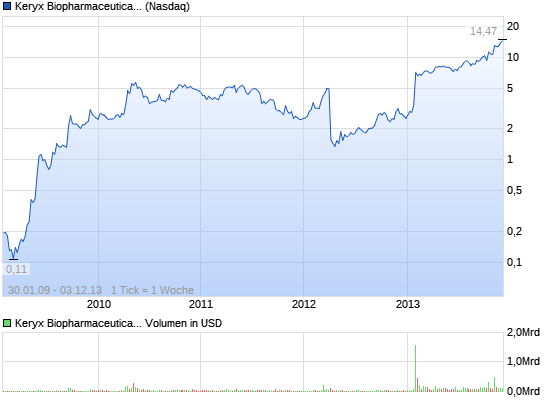
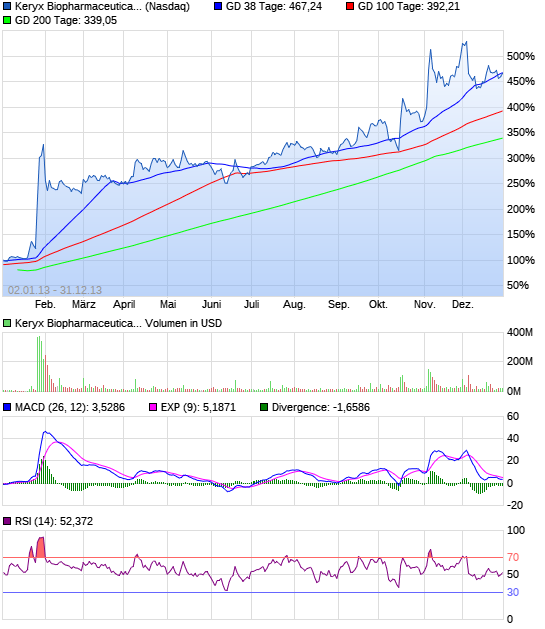
Keryx Biopharmaceuticals kündigt Emission von US-Patent für Zerenex (TM) Abdecken oral zu verabreichenden Form von Eisen-III-Citrat
http://finance.yahoo.com/news/...-announces-issuance-u-133000656.html
Keryx Biopharmaceuticals, Inc. 18. Dezember 2013 08.30 Uhr
NEW YORK, 18. Dezember 2013 (GLOBE NEWSWIRE) - Keryx Biopharmaceuticals, Inc. ( KERX ) gab heute bekannt, dass das US-Patent-und Markenamt hat US-Patent Nr. 8.609.896 erteilt. Das Patent, das im Jahr 2024 abgelaufen ist, beansprucht oral verabreichbaren Formen Zerenex von Eisencitrat hergestellt mit einer BET-aktive Oberfläche von mehr als etwa 16 m² / g auf. Die pharmazeutischen Wirkstoff (API) von Zerenex ist Eisencitrat mit einer BET-Oberfläche im wesentlichen oberhalb dieser Oberfläche Schwellenwert.
Das neu erteilte Patent weiter verbessert Taste Patentfamilie des Unternehmens, die US-Patente Nr. 7.767.851, 8.299.298 und 8.338.642 umfasst. Diese US-Patente laufen im Jahr 2024 ohne Patentlaufzeitverlängerung und enthalten Zusammensetzung und Verwendung der Claims Zerenex.
Ron Bentsur, Chief Executive Officer von Keryx, kommentierte: "Wir glauben, dass unser Portfolio von Patenten wird die Marktexklusivität für Zerenex bieten durch mindestens 2024, wie der Hoch API Oberfläche unserer Eisenzitrat ist für Zerenex" Tätigkeit und Auflösung. Die Patent heute veröffentlichten verbessert unsere IP-Portfolio durch den Schutz der oral anwendbare Formen der Zerenex. " Herr Bentsur fuhr fort: "Wir sind verpflichtet, den Schutz der langfristige Marktpotenzial für Zerenex durch die Stärkung des Patentportfolios und wir glauben, dass die heute erteilte Patent ist ein weiterer wichtiger Erfolg in Richtung dieses Ziels."
Das Unternehmen setzt auf weitere Patentanträge Zerenex, die, wenn sie ausgegeben werden, würde den Rahmen von Patentansprüchen für Zerenex über 2030 hinaus zu erweitern verfolgen.
Die Gesellschaft New Drug Application für Zerenex ist derzeit von der Food and Drug Administration mit einem zugewiesenen Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014.
Über Keryx Biopharmaceuticals, Inc.
Keryx Biopharmaceuticals ist auf den Erwerb, die Entwicklung und Vermarktung von medizinisch wichtigen pharmazeutischen Produkten für die Behandlung von Nierenerkrankungen konzentriert. Keryx entwickelt Zerenex (Eisenzitrat Koordinationskomplex), eine mündliche, Eisen-III-basierte Verbindung. Keryx hat einen US-amerikanischen klinischen Phase-3-Programm für Zerenex für die Behandlung von Hyperphosphatämie (erhöhte Phosphatspiegel) bei Patienten mit chronischer Nierenkrankheit, Dialyse, gemäß einem Special Protocol Assessment (SPA) Vereinbarung mit der Food and Drug Administration (abgeschlossen FDA). Die Gesellschaft New Drug Application (NDA) ist derzeit von der FDA mit einer zugeordneten Prescription Drug User Fee Act (PDUFA) Ziel Datum vom 7. Juni 2014. Die Marketing Authorization Application Einreichung bei der Europäischen Arzneimittel-Agentur (EMA) steht noch aus. Das Unternehmen entwickelt auch Zerenex in den USA für das Management der erhöhten Phosphor-und Eisenmangelanämie bei Patienten mit Stadium 3 bis 5 nicht-Dialyse abhängig chronischen Nierenerkrankung. Außerdem Keryx japanischen Partner, Japan Tobacco Inc. und Torii Pharmaceutical Co., Ltd hat seine New Drug Application für die Marktzulassung von Eisen-III-Citrat in Japan für die Behandlung von Hyperphosphatämie bei Patienten mit chronischer Nierenerkrankung eingereicht. Keryx hat seinen Hauptsitz in New York City.
Warnhinweis
Einige der in dieser Pressemitteilung, insbesondere im Zusammenhang mit dem geistigen Eigentum von Zerenex (Eisenzitrat Koordinationskomplex) enthalten Aussagen, Ergebnisse klinischer Studien, die klinischen Vorteile, die aus Zerenex abgeleitet werden, Zulassungsanträge und Zulassungen, die kommerziellen Chancen-und Wettbewerbs Positionierung, und alle Geschäftsaussichten für Zerenex, möglicherweise zukunftsgerichtete Aussagen, die eine Reihe von Risiken und Unsicherheiten beinhalten. Bei diesen Aussagen beanspruchen wir den Schutz der Safe-Harbor in dem Private Securities Litigation Reform Act von 1995 enthaltenen zukunftsgerichteten Aussagen. Zu den Faktoren, die dazu führen unsere tatsächlichen Ergebnisse abweichen könnten, sind: die Annahme der NDA-Antrag stellt nur eine vorläufige Bewertung der Anwendung und ist kein Hinweis auf Mängel, die bei der FDA-Überprüfung identifiziert werden kann, ein PDUFA Ziel Datum unterliegt zu verändern und garantiert nicht, dass die Überprüfung der NDA wird zeitnah abgeschlossen werden, das Risiko, dass die FDA, EMA, und / oder das japanische Ministerium für Gesundheit, Arbeit und Wohlfahrt letztlich verweigern Zustimmung der US-NDA, MAA und / oder japanischen NDA sind; die Gefahr, dass Schutzgebiete sind keine Garantie, dass die FDA genehmigt wird letztlich ein Produktkandidat folgenden Einreichung Annahme, ob die FDA und EMA mit unserer Interpretation unserer Phase-3-Studienergebnisse, unterstützende Daten oder stimmen die Durchführung von Studien, ob Zerenex, wenn genehmigt, wird erfolgreich eingeführt und vermarktet werden, sowie andere Risikofaktoren von Zeit zu Zeit in unseren Berichten an die Securities and Exchange Commission identifiziert. Alle zukunftsgerichteten Aussagen in dieser Pressemitteilung gelten nur ab dem Datum dieser Pressemitteilung. Wir sind nicht verpflichtet, diese zukunftsgerichteten Aussagen zu aktualisieren, um Ereignisse oder Umstände, die nach dem Datum dieser auftreten zu reflektieren. Diese Pressemitteilung und früheren Versionen sind verfügbar http://www.keryx.com . Die auf unserer Website Informationen nicht durch Bezugnahme in diese Pressemitteilung aufgenommen und wird nur zu Referenzzwecken enthalten.
Kontakt:
KERYX-Kontakt:
Lauren Fischer
Director - Investor Relations
Keryx Biopharmaceuticals, Inc.
Tel.: 212.531.5965
E-mail: lfischer@keryx.com |


 Thread abonnieren
Thread abonnieren